Organoalumiiniyhdisteet
Tässä artikkelissa aiomme tutkia perusteellisesti aihetta Organoalumiiniyhdisteet, joka on herättänyt suurta kiinnostusta ja kiistaa viime vuosina. Ilmestymisestään lähtien Organoalumiiniyhdisteet on herättänyt ihmisten huomion eri aloilta ja synnyttänyt intohimoisia keskusteluja ja ristiriitaisia mielipiteitä. Tämän analyysin avulla pyrimme tarkastelemaan yksityiskohtaisesti Organoalumiiniyhdisteet:een liittyviä eri näkökohtia, jotta voimme valaista sen merkitystä, vaikutuksia ja mahdollista tulevaa kehitystä. Monitieteisellä lähestymistavalla käsittelemme sekä sen historiallisia, kulttuurisia, sosiaalisia ja tieteellisiä ulottuvuuksia että asiaan liittyviä erilaisia näkökulmia pyrkiessämme tarjoamaan kattavan ja rikastuttavan näkemyksen Organoalumiiniyhdisteet:stä.

Organoalumiiniyhdisteet ovat organometalliyhdisteitä, jotka sisältävät alumiinin ja hiilen välisen kovalenttisen sidoksen. Organoalumiiniyhdisteitä käytetään muun muassa alkeenien polymeroinneissa, lineaaristen alkoholien valmistuksessa, muiden organometalliyhdisteiden valmistukseen, pelkistiminä ja elektroniikan komponenttien valmistuksessa. Organoalumiiniyhdisteitä tuotetaan ja käytetään vuosittain miljoonia kilogrammoja.[1][2][3][4][5]
Ominaisuudet
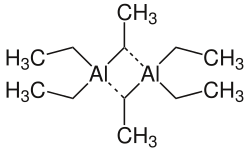
Yksinkertaiset trialkyyli- tai triaryylialumiiniyhdisteet (R3Al) ovat ulkomuodoltaan värittömiä nesteitä, tai alkyyliketjujen ollessa pitkiä valkoisia vahamaisia kiinteitä aineita. Ne eivät esiinny kiinteänä eivätkä liuoksissa monomeereina, kuin ainoastaan siinä tapauksessa, että alkyyliryhmät ovat voimakkaasti steerisesti estyneitä. Sen sijaan ne esiintyvät dimeereinä, joissa alumiini on koordinoitunut neljään alkyyliryhmään. Yksinkertaiset organoalumiiniyhdisteet ovat hyvin reaktiivisia. Ne hapettuvat helposti ilman hapen vaikutuksesta ja reagoi kiivaasti veden ja ilmankosteuden kanssa. Nämä reaktiot voivat olla pyroforisia, eli yhdiste voi syttyä palamaan. Tämän ominaisuuden vuoksi organoalumiiniyhdisteitä käytetään ja säilytetään suojakaasun kuten typen tai argonin alaisuudessa. Organoalumiiniyhdisteet voivat koordinoitua orgaanisten liuottimien kuten eetterien ja amiinien kanssa.[1][2][3][4][5]
Trialkyylialumiiniyhdisteiden lisäksi tunnetaan myös organoalumiinihalogenideja, joiden kaava voi olla RAlX2 ta R2AlX. Näissä halogeenin ollessa kloori, bromi tai jodi on rakenne trialkyylialumiiniyhdisteiden kaltainen dimeeri. Alkyylialumiinifluoridit sen sijaan esiintyvät useammin monomeerisina. Alkyylialumiinihalogenidit ovat hieman trialkyylialumiineja stabiilimpia hydrolyysiä tai hapettumista vastaan, mutta siltikin hyvin reaktiivisia. Tunnetaan myös voimakkaina pelkistimenä käytettäviä dialkyylialumiinihydridejä, kuten di-isobutyylialumiinihydridi.[1][2][3][4][5]
Valmistus
Laboratoriomittakaavassa käyttökelpoinen menetelmä organoalumiiniyhdisteiden valmistamiseen on vaihtometallointireaktio organoelohopeayhdisteiden kanssa. Teollisuudessa käytetympi menetelmä on alumiinin ja alkyylihalogenidin, tyypillisesti alkyylikloridin, välinen reaktio. Reaktiossa muodostuva seskvikloridivälivaihe muutetaan trialkyylialumiiniksi natriumin tai magnesiumin avulla. Toinen yleisesti käytetty menetelmä on niin kutsuttu hydroaluminointi, jossa metallinen alumiini ja vety reagoivat alkeenien kanssa pelkistimen kuten trialkyylialumiinin tai litiumalumiinihydridin läsnä ollessa.[1][2][3][4][5]
- 2 Al + 3 R2Hg → R6Al2 + 3 Hg
- 4 Al + 6 RCl → R4Al2Cl2 + R2Al2Cl4
- 3 Al + 3/2 H2 + 6 CH2=CHR → 3
Lähteet
- ↑ a b c d Alén, Raimo: Kokoelma orgaanisia yhdisteitä: Ominaisuudet ja käyttökohteet, s. 798. Helsinki: Consalen Consulting, 2009. ISBN 978-952-92-5627-3
- ↑ a b c d William C. Sleppy: Aluminum Compounds, Introduction, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, New York, 2002. Viitattu 25.5.2015
- ↑ a b c d Michael J. Krause, Frank Orlandi, Alfred T. Saurage & Joseph R. Zietz Jr.: Aluminum Compounds, Organic, Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, New York, 2000. Viitattu 25.5.2015
- ↑ a b c d N.N. Greenwood & A. Earnshaw: Chemistry of the Elements, s. 258–262, 265. (2nd Edition) Butterworth Heinemann, 1997. ISBN 0-7506-3365-4 (englanniksi)
- ↑ a b c d Jane E. Macintyre: Dictionary of Organometallic Compounds, s. 27. CRC Press, 1994. ISBN 9780412430602 Kirja Googlen teoshaussa Viitattu 25.5.2015. (englanniksi)
Aiheesta muualla
 Kuvia tai muita tiedostoja aiheesta Organoalumiiniyhdisteet Wikimedia Commonsissa
Kuvia tai muita tiedostoja aiheesta Organoalumiiniyhdisteet Wikimedia Commonsissa