Karbonyyliryhmä
Tässä artikkelissa käsitellään Karbonyyliryhmä:tä ja sen vaikutuksia nyky-yhteiskunnan eri osa-alueisiin. Karbonyyliryhmä on aihe, joka on herättänyt suurta kiinnostusta viime vuosina, koska se on relevanttia eri aloilla, kuten politiikassa, taloudessa, tekniikassa ja kulttuurissa. Seuraavilla riveillä analysoidaan Karbonyyliryhmä:n kehitystä ja vaikutuksia sekä sen vaikutusta ihmisten käyttäytymiseen ja tapaan, jolla suhtaudumme ympäröivään maailmaan. Samoin tarkastellaan erilaisia näkökulmia ja lähestymistapoja Karbonyyliryhmä:een, tarkoituksena tarjota kattava näkemys, jonka avulla voimme ymmärtää sen tärkeyden ja laajuuden nykyään.

Karbonyyliryhmä on orgaanisessa kemiassa funktionaalinen ryhmä, jossa hiili- ja happiatomi ovat kiinnittyneet toisiinsa kaksoissidoksella. Karbonyyliryhmä voi esiintyä molekyyleissä sellaisenaan, kuten ketoneissa, tai olla osa jotain isompaa funktionaalista ryhmää, kuten karboksyylihapoissa osa karboksyyliryhmää (-COOH) tai estereissä osa esteriryhmää (-COO-). Alla olevassa taulukossa on esitetty funktionaalisia ryhmiä, jotka sisältävät karbonyyliryhmän. Karbonyyliryhmä antaa näille yhdisteelle niille ominaisen kemiallisen luonteen.
| Yhdisteryhmä | Aldehydit | Ketonit | Karboksyylihapot | Esterit | Amidit | Enonit | Happokloridit | Anhydridit |
| Rakenne | 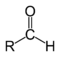 |
 |
 |
 |
 |
|||
| Rakennekaava | RCHO | RCOR' | RCOOH | RCOOR' | RCONHR' | RC(O)C(R')=CR''R''' | RCOCl | (RCO)2O |
Karbonyyliryhmän rakenne

Karbonyyliryhmän hiili- ja happiatomi ovat sp2-hybridisoituneet, joten niillä on kolme sp2-orbitaalia, joista yhdellä ne muodostavat σ-sidoksen ja p-orbitaaleilla π-sidoksen, aivan kuten alkeeneissa. Hapen kaksi vapaata elektroniparia miehittävät jäljellä olevat sp2-orbitaalit. Karbonyyliryhmän atomit ovat tasossa ja atomien väliset sidoskulmat ovat n. 120°. Karbonyylisidos on lyhyempi kuin yksinkertainen C–O-sidos. Hiili-happi kaksoissidos on poolinen, johtuen hapen elektronegatiivisuudesta. Koska karbonyylihiilellä on positiivinen osittaisvaraus, se on molekyylin elektrofiilinen osa (Lewisin happo), johon nukleofiilit pyrkivät reagoimaan. Vastaavasti karbonyylihappella on negatiivinen osittaisvaraus ja se on molekyylin nukleofiilinen osa (Lewisin emäs).
Reaktiivisuus
Karbonyyliryhmän happiatomi on elektronegatiivisempi kuin hiili, ja siksi se vetää elektroneja puoleensa ja tekee sidoksesta poolisen. Tämän vuoksi karbonyyliryhmän hiiliatomi on elektrofiilinen ja se voi reagoida nukleofiilien kanssa. Karbonyyliryhmän elektronegatiivinen happiatomi voi vastaavasti reagoida elektrofiilien, esimerkiksi protonin kanssa happamassa liuoksessa.
Karbonyyliryhmän vieressä oleva alfa-vety on huomattavasti happamampi (noin 1030 kertaa) kuin tavallinen CH-sidos. Esimerkiksi asetaldehydin ja asetonin pKa-arvot ovat 16.7 ja 19.
Amidit ovat kaikkein pysyvimpiä karbonyyliyhdisteitä, mikä johtuu typpi-hiili- ja hiili-happiatomien välisistä resonanssistabiloiduista sidoksista.
Karbonyyliryhmä voidaan pelkistää hydridireagenssien, kuten NaBH4:n ja LiAlH4:n, avulla, sekä organometallireagenssien, kuten organolitiumreagenssien ja Grignardin reagenssien, avulla.
Muita tärkeitä reaktioita:
- Wolff–Kishner-pelkistys
- Clemmensen-pelkistys
- Muuttuminen tioasetaaliksi
- Hemiasetaaliie ja hemiketaaliksien, ja lopulta asetaalien ja ketaalien muodostuminen
- Reaktio ammoniakin ja primääristen tai sekundääristen amiinien kanssa muodostaa imiinejä
- Reaktio hydroksyyliamiinin kanssa muodostaa oksiimeja
- Reaktio syanidianionin kanssa muodostaa syanohydriinejä
- Reaktio Tebben reagenssin ja fosfoniumylidin kanssa muodostaa alkeeneja.
- Perkins-reaktio
- Tishchenko-reaktio
- Aldolikondensaatio
- Cannizzaro-reaktio