Kloraatti
Tämä artikkeli käsittelee aihetta Kloraatti, joka on ollut keskustelun ja kiinnostuksen kohteena eri aloilla. Kloraatti on herättänyt suurta huomiota sen merkityksen vuoksi nyky-yhteiskunnassa ja sen vaikutuksesta jokapäiväisen elämän eri osa-alueisiin. Kautta historian Kloraatti:llä on ollut perustavanlaatuinen rooli ihmiskunnan kehityksessä, ja se on ollut useiden tieteenalojen tutkimuksen ja tutkimuksen kohteena. Tässä mielessä analysoidaan erilaisia Kloraatti:een liittyviä näkökulmia ja lähestymistapoja, tavoitteena tarjota kattava ja rikastuttava näkemys tästä aiheesta. Tarkan ja kriittisen analyysin avulla pyritään syventämään eri näkökohtia, jotka ovat ominaisia Kloraatti:lle, sekä sen vaikutuksiin ja vaikutuksiin nykyään.
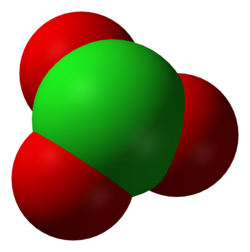

Kloraatti on kloorihaposta peräisin oleva anioni, jonka kemiallinen kaava on ClO3-. Kloraatit ovat voimakkaita hapettimia, ja kloorin hapetusluku kloraatti-ionissa on +V.[1] Kloraatit ovat yleensä hyvin vesiliukoisia. Kuumennettaessa kloraatit hajoavat, jolloin muodostuu lämpötilasta riippuen joko perkloraatteja ja klorideja tai happea ja klorideja:
Hapot hajottavat kloraatti-ionin perkloraatiksi ja klooridioksidiksi:
3 ClO3- + 2 H+ → 2 ClO2(g) + ClO4-
Voimakkaat pelkistimet pelkistävät kloraatti-ionin kloridiksi:
ClO3- + 3 Zn + 6 H+ → Cl- + 3 Zn2+ + 3 H2O
Kloraatit tulisi pitää erillään orgaanisista tai helposti hapettuvista materiaaleista, koska ne muodostavat herkästi syttyviä tai räjähtäviä seoksia. Kloraatteja käytettiin paljon pyrotekniikassa; tosin niiden käyttö väheni epävakaudesta johtuen.
Kloraatteja
- Bariumkloraatti, BaCl2O6/Ba(ClO3)2, CAS-numero 13477-00-4
- Kaliumkloraatti, ClKO3/KClO3, CAS-numero 3811-04-9
- Natriumkloraatti, NaClO3, CAS-numero 7775-09-9
Lähteet
- ↑ E. M. Karamäki: Epäorgaaniset kemikaalit, s. 268. Kustannusliike Tietoteos, 1983. ISBN 951-9035-61-3